
免疫疗法有一个非常重要的问题,那就是你愿意花多少钱买一个月的命,花多少钱买一年的命 (Science,2018)
肿瘤免疫的定义是动员病人自体的免疫系统,去杀死肿瘤细胞从而达到治疗癌症的作用。目前应用在临床上并取得了很好效果的是如下三个方向的免疫疗法:免疫检查点阻断,CAR-T细胞治疗,肿瘤疫苗。
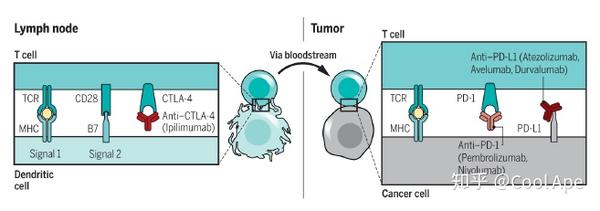
1)免疫检查点阻断:通过阻断免疫抑制通路,激活免疫细胞。主要靶点是PD1/PDL1通路,CTLA4通路。基本使用阻断抗体。目前最多的临床试验方案就是各种找CP,各种联用,一线使用。只要有响应的病人,获益一般超过化疗。
最大的问题,响应率不够。除了几种高响应率的疾病:霍奇金淋巴瘤(87%),黑色素瘤(40-70%),Merkel细胞瘤(56%),高MSI癌症(53%)。剩下的响应率都十分感人,非小细胞肺癌(20%),头颈癌,胃癌,膀胱及尿道癌(15%),肾癌(25%)。为什么响应率不高?不知道。有没有响应率的Biomarker?没有。这两点是亟待解决的。
小分子免疫抑制剂或者免疫调控剂的研究,今年凉了一个IDO抑制剂,和PD1抗体联用治疗黑色素瘤三期临床失败。但也不能把IDO一棒子打死,毕竟一期二期数据惊艳。可能换个适应症和给药方式结果就不一样了。靶向PD-L1和VISTA的口服小分子抑制剂CA170还在临床试验,等待三期结果。
2)Car-T细胞治疗。
过继T细胞疗法(adoptive T cell transfer, ACT)是免疫治疗的一个比较新的领域,它指通过给患者注射T细胞,来达到抗肿瘤,抗病毒和抗感染的目的。针对肿瘤治疗领域,科学家开发了三种ACT的策略:TCR-T, Car-T, TIL。相对于Car-T疗法,另外两种还处于研究早期阶段。
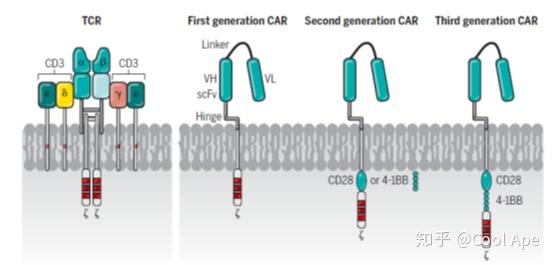
Car-T的全称是嵌合抗原受体T细胞免疫疗法,它的基本概念就是改造病人自身的T细胞,让它们特异性识别并杀伤病人本身的癌细胞,然后把改造扩增后的的T细胞回输到病人身体里,起到抗肿瘤的作用。对T细胞的改造包括在TCR上连接一个特异识别肿瘤膜蛋白的单链抗体,从而引导T细胞识别癌细胞;在TCR的胞内区域,连接激活T细胞的信号蛋白,比如CD28或者4-1BB,使得T细胞在接触癌细胞后,被激活,从而大量扩增。
2017年,FDA批准CAR-T上市诺华的Kymriah率先获批上市,获批适应症是儿童和年轻成人急性淋巴细胞白血病(ALL),定价47.5万美元,并承诺无效退款。临床实验中,客观反应率为82.5%,完全缓解率为63%。一个多月后,Kite的Yescarta第二个获得FDA批准上市,适应症与诺华的不同,为成人复发或难治性大B细胞淋巴瘤,定价为37.3万美元。客观缓解率82%,完全缓解率54%。六个月后,完全缓解率依然能够达到36%。但有一例患者因脑水肿副作用死亡。这两个产品都是靶向CD19蛋白阳性表达的肿瘤细胞。
2017年12月11日,南京传奇生物科技有限公司提交CAR-T疗法中国临床申请获得CDE正式承办受理,这是国内首个获得受理的CAR-T产品。南京传奇的Car-T靶向多发性骨髓瘤BCMA靶点,35名既往治疗后复发的多发性骨髓瘤患者中,有33人(94%)在接受公司试验性抗BCMA CAR-T细胞(LCAR-B38M)治疗后2个月获得临床缓解,显示明显的骨髓瘤临床缓解(完全反应或非常好的部分反应),客观缓解率达到100%!其中14名达到了严格的完全缓解。杨森公司Janssen Biotech 以3.5亿美金的先期付款,与南京传奇达成了合作协议,在大中华地区,Janssen与南京传奇将以30/70的比例共同承担成本和分享收益。在全球的其他地区,这一比例为50/50。
在此利好下,大量中国生物科技公司开始申请Car-T临床实验。绝大部分中国公司申请的Car-T靶向CD19,与上市Car-T相同。
Car-T在血液癌症中的成功和挑战
无论是靶向CD19还是靶向BCMA的Car-T都是治疗B细胞相关癌症,比如急性B细胞白血病及多发性骨髓瘤。包括目前临床实验最多的Car-T靶点,也基本集中于血癌(图2)。包括CD138 (多发性骨髓瘤),CD38 (急性髓系白血病),CD123(急性髓性白血病),CD33(急性髓性白血病),CD30 (淋巴瘤),CD22(淋巴瘤,B细胞急性白血病),CD20 (急性B细胞白血病)。
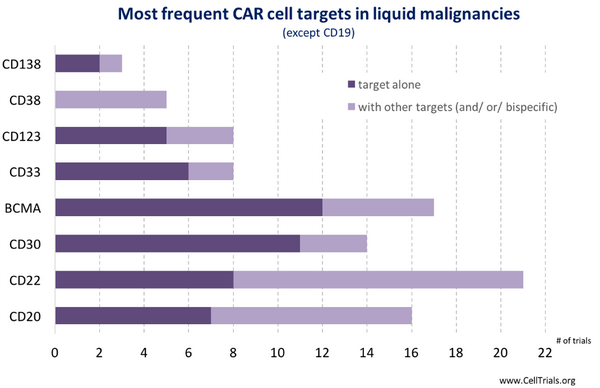
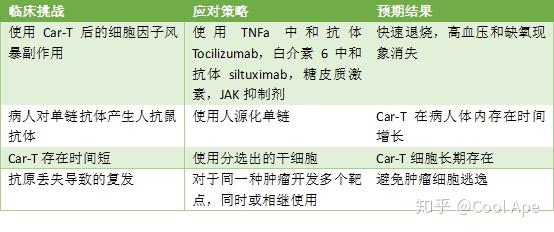
之所以CD19会成为一个Car-T(几乎)完美的靶点,主要是因为它有如下几个特征:在B细胞癌症上大量表达,与B细胞发育密切相关,在B细胞以外的健康组织里面没有表达。即使Car-T细胞完全清除B细胞,人体也能在一段时间内自行恢复。在目前已经进行的临床实验中,白血病病人在使用靶向CD19的Car-T后,大部分能达到完全缓解。然而,两种不同耐药形式慢慢浮现。1)癌细胞突变,丢失CD19抗原:28%的ALL患者在接受治疗后产生了此类突变,从而复发;所以现在一个非常火热的研究靶点是CD22,可以作为CD19抗原消失后的替代靶点;2)对于CLL患者,复发的主要原因是部分患者Car-T细胞注射后, T细胞很快就不再增殖。下面的表格总结了一下目前血液瘤Car-T临床上的挑战和应对措施:
Car-T疗法在实体瘤中的现状及挑战
绝大部分癌症患者所患为实体瘤,然而与疗效显著的血液瘤相比,Car-T在实体瘤治疗中,还存在各种各样的问题及挑战。Her2/ERBB2是被临床验证过的实体瘤的单抗药物、抗体偶联药物靶点,在很多癌症组织中都极高表达。然而,靶向Her2的Car-T在第一例临床实验中,就因为副作用导致了患者死亡。后来发现死亡原因是与Her2结合的高亲和力的Car-T,结合并杀伤了健康肺部少量表达Her2的细胞,导致肺功能丧失及细胞因子风暴。另外一个临床试验,使用了低亲和力结合Her2的Car-T细胞治疗肉瘤,证实是安全的,然而只是略有药效。所以亲和力的高低与药效及毒性密切相关,但每一个靶点都可能有所不同。怎样找到最合适的亲和力,还需继续探索。
可以看出与血液瘤相比,实体瘤Car-T的一个巨大挑战是:实体瘤癌细胞来源于健康组织,尤其是健康上皮组织,所以很难找到一个只在肿瘤细胞中存在,而不在健康组织里表达的Car-T靶点,这就使得Car-T存在产生健康组织毒副作用的可能。使用低亲和力的Car-T可能能够解决安全性问题,但相应的药效会下降。另外一个潜在的解决方法是使用多靶点Car-T,降低健康组织的结合。比如肿瘤细胞高表达A+B, 健康组织只表达A或者B,那使用A和B同时识别的Car-T,可以使Car-T高亲和力结合肿瘤细胞,而低亲和力结合健康组织。另外一个策略是在Car-T细胞上装载自杀信号,防止其过度增殖
血液瘤中的Car-T细胞静脉注射后,Car-T在循环系统中就可以和癌细胞发生接触,从而起效。而在实体瘤Car-T的另外一个问题就是肿瘤组织过于致密,T细胞很难进入肿瘤组织中。所以现在临床上Car-T效果比较好的实体瘤种类为肺癌,黑色素瘤,肾癌,卵巢癌,前列腺癌(均为T细胞浸润较多的肿瘤类型),以及脑胶质瘤(可以颅腔直接注射Car-T)。
实体肿瘤Car-T面临的第三个挑战是实体瘤的免疫抑制微环境,使Car-T细胞很难被激活扩增。现在的思路是Car-T与PD-1/PD-L1等检查点疗法联合应用,从而解除免疫抑制。

目前国内实体瘤Car-T靶点及临床试验
目前全球已经有超过100个针对实体瘤的临床试验正在进行,其中一半在政策宽松的中国大陆。这对研究者和病人都是利好。研究者可以很快的在临床上验证药效,而患者择有了新的希望。下表概括了部分国内开展的实体瘤临床试验。
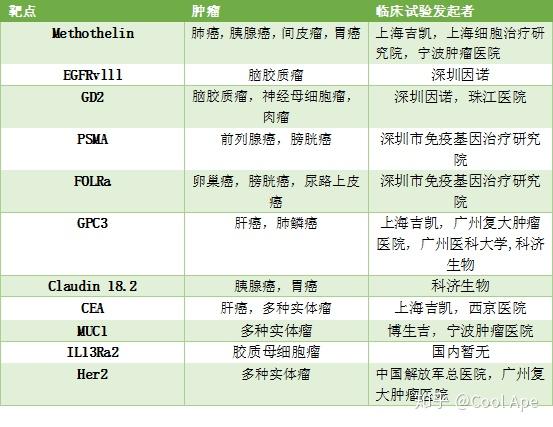
总而言之,目前存在问题:对于血液瘤:1,一次治疗后产生耐药,解决方法多靶点Car-T;2,部分患者的T细胞扩增失败,解决方法是开发通用型Car-T,把所有TCR都敲除干净。
对于实体瘤:1,免疫抑制微环境影响了Car-T的疗效,影响T细胞扩增。现在的研究方向是和各种免疫激活疗法联用,很多公司尝试在Car-T上表达可溶性PD1之类;2,on tumor, off target毒性,现在的解决方法是开发多特异Car-T,或者装载各种开关。
3)肿瘤疫苗
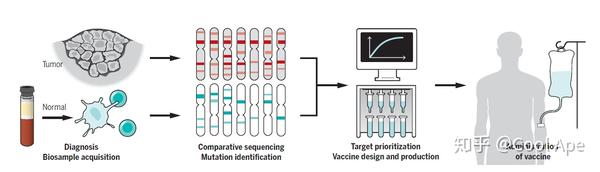
HPV疫苗已经广泛应用了,这个就不说了。另外肿瘤疫苗未来最大的潜力在于应用于个体化治疗。肿瘤一个重要特征就是遗传改变的积累, 这些突变产生的肿瘤抗原多肽,可以被自体T细胞识别,是很好的肿瘤疫苗靶点。每种肿瘤都有非常特异的突变,而且每个病人之间的突变也非常不一样。所以肿瘤疫苗有可能能够成为第一个真正意义上的个体化治疗手段。已经有三个恶性黑色素瘤的个体化疫苗治疗临床试验正在进行(我个人觉得恶黑会是第一个被彻底治愈的实体瘤),前期结果证实了药效及安全性。
4)其他
除了上面三个进展比较好的免疫疗法,还有很多其他尝试,比如微生物组学。肠道微生物领域这两年火到吃屎疗法都有人研究,但这并不是没有道理。除了疾病状态人体微生物组和健康差异巨大,微生物组和肿瘤免疫治疗的效果有非常明显的关系,抗生素可以很明显的降低PD1疗法的疗效,而特定的肠道微生物组的存在,预示着非常好的PD1疗效。未来微生物组在免疫疗法里面的应用,不管是诊断还是治疗,都是很有潜力的。
还有针对肿瘤相关巨噬细胞的疗法,巨噬细胞可塑性非常强,可以是抗癌的M1型,也可以是促进癌症抑制免疫的M2型,遗憾的是,肿瘤微环境中,巨噬细胞基本都是M2型。靶向肿瘤相关巨噬细胞最知名的例子应该是靶向并阻断CD47/SIRPa通路,从而促进巨噬细胞对肿瘤细胞吞噬的尝试。CD47高表达在肿瘤细胞上,通过结合肿瘤浸润巨噬细胞的SIRPa,告诉巨噬细胞,"别吃我,友军"。通过CD47中和抗体阻断了之后,巨噬细胞开始攻击吞噬肿瘤细胞。最早的两个临床一期试验(实体瘤和淋巴瘤)今年应该会公布数据,根据去年年底的结果,安全性没有问题。另外一个靶向Macrophage的尝试是直接清除M2 Macrophage,比如使用CSF1R的阻断抗体,可以直接杀死M2巨噬细胞,和PD1疗法联用,临床前效果极好。临床试验还没有结论。但有报道说,清除了巨噬细胞,反而有免疫抑制性更强的mdsc细胞替代巨噬细胞浸润到肿瘤里,这就很尴尬了。
除此之外还有林林总总很多临床前的尝试,我们拭目以待。
上面我总结了几个肿瘤免疫疗法目前存在的问题,但免疫疗法其实还有一个非常重要的问题,那就是你愿意花多少钱买一个月的命,花多少钱买一年的命。免疫检查点抑制剂一年15万美金,大部分癌症只有20%响应率。诺华Car-T一个疗程47万美金,相当概率复发。1995年,使用抗癌药物延续一年寿命的成本是54000美金,到现在,这个数字是25万美金。这个问题的解决也许依赖于突破性的技术,也许依赖于整个产业链的进步,但肯定不是一朝一夕的。Finger's crossed。
主要参考文献及图片来源
Science, 359, 2018肿瘤免疫特刊
Li et al. Journal of Hematology & Oncology (2018) 11:22
来源:知乎 www.zhihu.com
作者:Cool Ape
【知乎日报】千万用户的选择,做朋友圈里的新鲜事分享大牛。 点击下载
没有评论:
发表评论